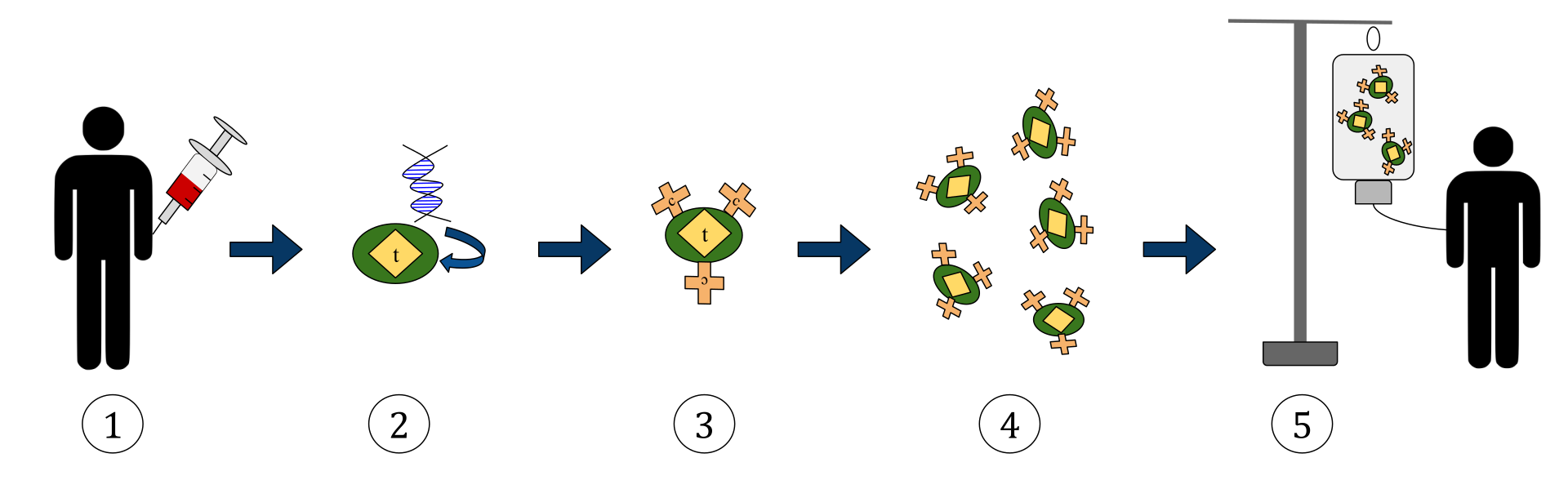
Diagrammet ovenfor representerer prosessen med kimær antigenreseptor T-cellebehandling (CAR). Dette er en metode for immunterapi, som er en økende praksis innen behandling av kreft. Det endelige resultatet skal være en produksjon av utstyrte T-celler som kan gjenkjenne og bekjempe de infiserte kreftcellene i kroppen.
1. T-celler (representert av gjenstander merket som ‘t’) fjernes fra pasientens blod.
2. Deretter blir genet som koder for de spesifikke antigenreseptorene i et laboratorium innlemmet i T-cellene.
3. Dermed produseres CAR-reseptorene (merket som c) på overflaten av cellene.
4. De nylig modifiserte T-cellene høstes videre og dyrkes i laboratoriet.
5. Etter en viss periode tilføres de konstruerte T-cellene tilbake til pasienten.
Kimære antigenreseptor T-celler (også kjent som CAR T-celler) er T-celler som er genetisk konstruert for å produsere en kunstig T-celle reseptor for bruk i immunterapi.
Kimære antigenreseptorer (Biler, også kjent som kimære immunreseptorer, kimære T-celle reseptorer, eller kunstige T-celle reseptorerer reseptorproteiner som er konstruert for å gi T-celler den nye evnen til å målrette mot et spesifikt protein. Reseptorene er kimære fordi de kombinerer både antigenbindende og T-celleaktiverende funksjoner til en enkelt reseptor.
CAR-T-celleterapi bruker T-celler konstruert med CAR for kreftterapi. Forutsetningen med CAR-T immunterapi er å modifisere T-celler for å gjenkjenne kreftceller for mer effektivt å målrette og ødelegge dem. Forskere høster T-celler fra mennesker, endrer dem genetisk og tilfører deretter de resulterende CAR-T-cellene til pasienter for å angripe svulstene. CAR-T-celler kan enten være avledet fra T-celler i pasientens eget blod (autolog) eller avledet fra T-cellene til en annen sunn donor (allogen). Når de er isolert fra en person, er disse T-cellene genetisk konstruert for å uttrykke en spesifikk BIL, som programmerer dem til å målrette mot et antigen som er tilstede på overflaten av svulster. For sikkerhets skyld er CAR-T-celler konstruert for å være spesifikke for et antigen uttrykt på en svulst som ikke uttrykkes på friske celler.
Etter at CAR-T-celler er infundert til en pasient, fungerer de som et «levende stoff» mot kreftceller. Når de kommer i kontakt med det målrettede antigenet på en celle, binder CAR-T-celler seg til det og blir aktivert, og fortsetter deretter med å spre seg og bli cellegiftende. CAR-T-celler ødelegger celler gjennom flere mekanismer, inkludert omfattende stimulert celleproliferasjon, og øker graden de er giftige for andre levende celler (cytotoksisitet) og ved å forårsake økt sekresjon av faktorer som kan påvirke andre celler som cytokiner, interleukiner og vekstfaktorer.
Produksjon av CAR-T-celler

Det første trinnet i produksjonen av CAR-T-celler er isolering av T-celler fra humant blod. CAR-T-celler kan produseres enten fra pasientens eget blod, kjent som en autolog behandling, eller fra blodet fra en sunn donor, kjent som en allogen behandling. Produksjonsprosessen er den samme i begge tilfeller; bare valget av den første blodgiveren er annerledes.
Først blir leukocytter isolert ved hjelp av en blodcellseparator i en prosess kjent som leukocyttaferese. Perifere mononukleære blodceller (PBMC) blir deretter separert og samlet. Produktene av leukocyttaferese blir deretter overført til et cellebehandlingssenter. I cellebehandlingssenteret stimuleres spesifikke T-celler slik at de aktivt vil spre seg og utvide seg til et stort antall. For å drive ekspansjonen blir T-celler vanligvis behandlet med cytokin interleukin 2 (IL-2) og anti-CD3 antistoffer.
De ekspanderte T-cellene blir renset og deretter transdusert med et gen som koder for den konstruerte CAR via en retroviral vektor, typisk enten en integrerende gammaretrovirus (RV) eller en lentiviral (LV) vektor. Disse vektorene er veldig trygge i moderne tid på grunn av en delvis sletting av U3-regionen. Det nye genredigeringsverktøyet CRISPR / Cas9 har nylig blitt brukt i stedet for retrovirale vektorer for å integrere CAR-genet i spesifikke steder i genomet.
Pasienten gjennomgår kjemoterapi med lymfefortynning før introduksjonen av de konstruerte CAR-T-cellene. Utarmingen av antall sirkulerende leukocytter i pasienten oppregulerer antall cytokiner som produseres og reduserer konkurransen om ressurser, noe som bidrar til å fremme utvidelsen av de konstruerte CAR-T-cellene.
Kliniske applikasjoner
I mars 2019 skjedde det rundt 364 pågående kliniske studier globalt med CAR-T-celler. Flertallet av disse studiene retter seg mot blodkreft: CAR-T-terapier står for mer enn halvparten av alle studier for hematologiske maligniteter. CD19 fortsetter å være det mest populære antigenmålet, etterfulgt av BCMA (ofte uttrykt i myelomatose). I 2016 begynte studier å utforske levedyktigheten til andre antigener, for eksempel CD20. Forsøk for solide svulster er mindre dominert av CAR-T, med omtrent halvparten av celleterapibaserte studier som involverer andre plattformer som NK-celler.
Kreft
T-celler er genetisk konstruert for å uttrykke kimære antigenreseptorer spesifikt rettet mot antigener på pasientens svulstceller, og deretter infundert til pasienten der de angriper og dreper kreftcellene. Adoptiv overføring av T-celler som uttrykker biler er en lovende antikreftterapeutisk terapi, fordi BIL-modifiserte T-celler kan konstrueres for å målrette nesten hvilket som helst tumorassosiert antigen.
Tidlig CAR-T-celleforskning har fokusert på blodkreft. De første godkjente behandlingene bruker biler som retter seg mot antigenet CD19, som er tilstede i kreft i B-celler, som akutt lymfoblastisk leukemi (ALL) og diffust stort B-celle lymfom (DLBCL). Det pågår også forsøk på å konstruere biler rettet mot mange andre blodkreftantigener, inkludert CD30 i ildfast Hodgkins lymfom; CD33, CD123 og FLT3 ved akutt myeloid leukemi (AML); og BCMA ved myelomatose.
Solide svulster har presentert et vanskeligere mål. Identifisering av gode antigener har vært utfordrende: slike antigener må uttrykkes sterkt på de fleste kreftceller, men i stor grad fraværende i normalt vev. CAR-T-celler traffiseres heller ikke effektivt inn i sentrum av solide svulstmasser, og det fiendtlige svulstens mikromiljø undertrykker T-celleaktivitet.
Autoimmun sykdom
Mens de fleste CAR T-celle studier fokuserer på å lage en CAR T-celle som kan utrydde en viss cellepopulasjon (for eksempel CAR T-celler som er målrettet mot lymfomceller), er det andre potensielle bruksområder for denne teknologien. T-celler kan også beskytte selvantigener fra autoimmune reaksjoner. En regulatorisk T-celle utstyrt med en CAR kan ha potensial til å gi toleranse for et spesifikt antigen, noe som kan brukes i organtransplantasjon eller revmatiske sykdommer som lupus.
Satefy
Det er alvorlige bivirkninger som skyldes at CAR-T-celler blir introdusert i kroppen, inkludert cytokinfrigivelsessyndrom og nevrologisk toksisitet. Fordi det er en relativt ny behandling, er det lite data om langtidseffekten av CAR-T-celleterapi. Det er fortsatt bekymringer om langvarig pasientoverlevelse, samt graviditetskomplikasjoner hos kvinnelige pasienter behandlet med CAR-T-celler. Anafylaksi er en forventet bivirkning, da CAR er laget med et fremmed monoklonalt antistoff og som et resultat provoserer en immunrespons.
On-target / off-tumor anerkjennelse oppstår når CAR-T-cellen gjenkjenner riktig antigen, men antigenet uttrykkes på sunt, ikke-patogent vev. Dette resulterer i at CAR-T-celler angriper ikke-tumorvev, slik som sunne B-celler som uttrykker CD19. Alvorlighetsgraden av denne bivirkningen kan variere fra B-celle aplasi, som kan behandles med støtteinfusjoner, til ekstrem toksisitet som fører til døden.
Det er også den usannsynlige muligheten for at de konstruerte CAR-T-cellene selv vil bli transformert til kreftceller gjennom innsettingsmutagenese, på grunn av at virusvektoren setter inn CAR-genet i en tumorundertrykker eller onkogen i verts-T-cellens genom. Noen retrovirale (RV) vektorer har lavere risiko enn lentivirale (LV) vektorer. Begge har imidlertid potensial til å være onkogene. Genomisk sekvenseringsanalyse av CAR-innsettingssteder i T-celler er etablert for bedre forståelse av CAR T-cellefunksjon og utholdenhet in vivo.
Cytokin release syndrom
Det vanligste problemet etter behandling med CAR-T-celler er cytokinfrigivelsessyndrom (CRS), en tilstand der immunforsvaret aktiveres og frigjør et økt antall inflammatoriske cytokiner. Den kliniske manifestasjonen av dette syndromet ligner sepsis med høy feber, tretthet, myalgi, kvalme, kapillærlekkasjer, takykardi og annen hjertesvikt, leversvikt og nedsatt nyre. CRS forekommer hos nesten alle pasienter behandlet med CAR-T-cellebehandling; faktisk er tilstedeværelsen av CRS en diagnostisk markør som indikerer at CAR-T-cellene fungerer som ment å drepe kreftcellene. Merk imidlertid at en høyere grad av CRS-alvorlighetsgrad ikke korrelerer med økt respons på behandlingen, men snarere høyere sykdomsbyrde.
Immuneffektorcelleassosiert nevrotoksisitet
Nevrologisk toksisitet er også ofte assosiert med CAR-T-cellebehandling. Den underliggende mekanismen er dårlig forstått, og kan eller ikke være relatert til CRS. Kliniske manifestasjoner inkluderer delirium, delvis tap av evnen til å snakke sammenhengende mens man fremdeles har evnen til å tolke språk (ekspressiv afasi), senket årvåkenhet (obtundasjon) og kramper. I noen kliniske studier har dødsfall forårsaket av nevrotoksisitet skjedd. Den viktigste dødsårsaken fra nevrotoksisitet er hjerneødem. I en studie utført av Juno Therapeutics, Inc., døde fem pasienter som var registrert i studien som et resultat av hjerneødem. To av pasientene ble behandlet med cyklofosfamid alene, og de resterende tre ble behandlet med en kombinasjon av cyklofosfamid og fludarabin. I en annen klinisk studie sponset av Fred Hutchinson Cancer Research Center, var det et rapportert tilfelle av irreversibel og dødelig nevrologisk toksisitet 122 dager etter administrering av CAR-T-celler.
.


Discussion about this post