| Alfa-amylase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
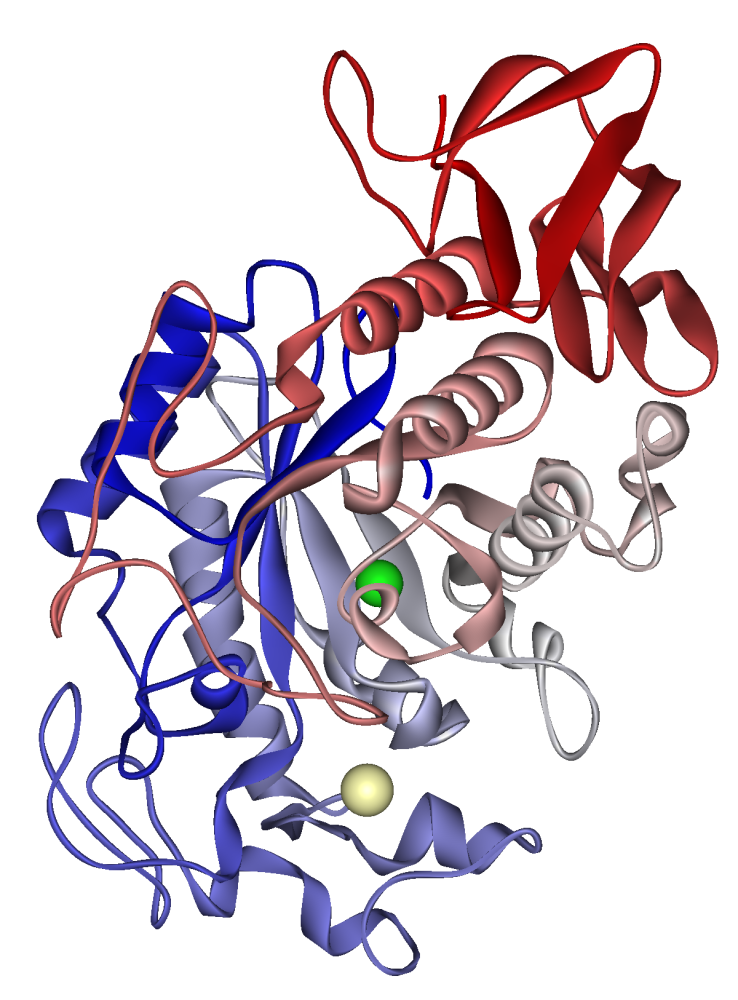
Human spyttamylase: kalsiumion synlig i blek kaki, klorion i grønt. FBD 1SMD
|
|||||||||
| Identifikatorer | |||||||||
| EF-nr. | 3.2.1.0 | ||||||||
| CAS-nr. | 9000-90-2 | ||||||||
| Databaser | |||||||||
| IntEnz | IntEnz-visning | ||||||||
| BRENDA | BRENDA-oppføring | ||||||||
| EXPASy | Fin utsikt over utsikten | ||||||||
| KEGG | KEGG-oppføring | ||||||||
| MetaCyc | metabolsk vei | ||||||||
| PRIAM | profil | ||||||||
| FBF-strukturer | RCSB PDB PDBe PDBsum | ||||||||
|
|||||||||
| GH13 katalytisk domene | |||||||||
|---|---|---|---|---|---|---|---|---|---|

Syklodextrin glukanotransferase (ec2.4.1.19) (cgtase)
|
|||||||||
| Identifikatorer | |||||||||
| Symbol | Alfa-amylase | ||||||||
| Pfam | PF00128 | ||||||||
| Pfam-klanen | CL0058 | ||||||||
| InterPro | IPR006047 | ||||||||
| SCOP2 | 1ppi / SCOPe / SUPFAM | ||||||||
| OPM superfamilie | 117 | ||||||||
| OPM protein | 1wza | ||||||||
| CAZy | GH13 | ||||||||
| CDD | cd11338 | ||||||||
|
|||||||||
| Alpha-amylase C-terminal beta-ark domene | |||||||||
|---|---|---|---|---|---|---|---|---|---|

Krystallstruktur av bygg alfa-amylase isozym 1 (amy1) inaktiv mutant d180a i kompleks med maltoheptaose
|
|||||||||
| Identifikatorer | |||||||||
| Symbol | Alpha-amyl_C2 | ||||||||
| Pfam | PF07821 | ||||||||
| InterPro | IPR012850 | ||||||||
|
|||||||||
| Alpha amylase, C-terminal all-beta domain | |||||||||
|---|---|---|---|---|---|---|---|---|---|
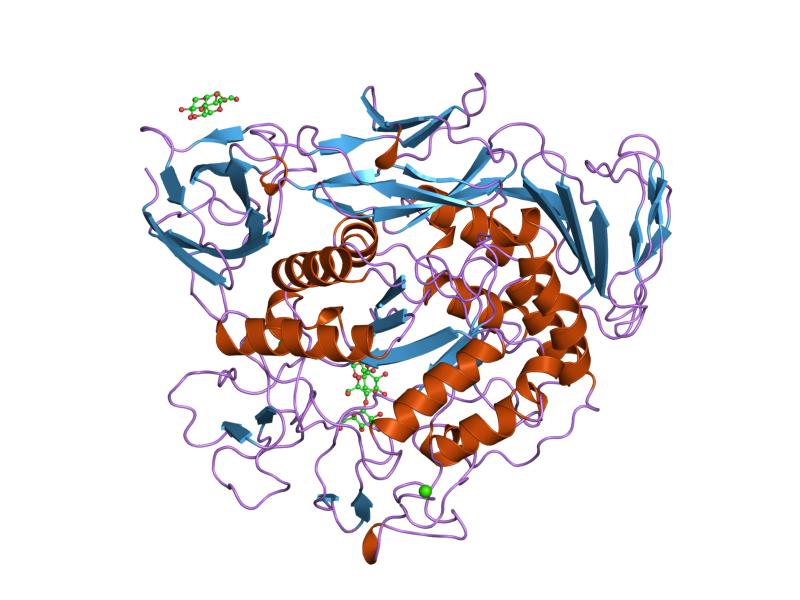
maltotrioskompleks av forhåndskondisjonert cyklodextrin glykosyltransferasemutant
|
|||||||||
| Identifikatorer | |||||||||
| Symbol | Alpha-amylase_C | ||||||||
| Pfam | PF02806 | ||||||||
| Pfam-klanen | CL0369 | ||||||||
| InterPro | IPR006048 | ||||||||
| SCOP2 | 1ppi / SCOPe / SUPFAM | ||||||||
|
|||||||||
Alfa-amylase, (α-amylase) er et enzym EC 3.2.1.1 som hydrolyserer alfa-bindinger av store, alfa-koblede polysakkarider, slik som stivelse og glykogen, og gir kortere kjeder derav, dekstriner og maltose. Det er den viktigste formen for amylase som finnes hos mennesker og andre pattedyr. Den er også tilstede i frø som inneholder stivelse som matreserve, og utskilles av mange sopper. Det er et medlem av glykosidhydrolasefamilien 13.
I menneskelig biologi
Selv om det finnes i mange vev, er amylase mest fremtredende i bukspyttkjerteljuice og spytt, som hver har sin egen isoform av human α-amylase. De oppfører seg annerledes på isoelektrisk fokusering, og kan også skilles fra hverandre ved testing ved å bruke spesifikke monoklonale antistoffer. Hos mennesker kobles alle amylase-isoformer til kromosom 1p21 (se AMY1A).
Spyttamylase (ptyalin)
Amylase finnes i spytt og bryter stivelse i maltose og dekstrin. Denne formen for amylase kalles også «ptyalin» /ˈtaɪəlɪn/, som ble oppkalt av svensk kjemiker Jöns Jacob Berzelius. Navnet stammer fra det greske ordet πτυω (jeg spytter), fordi stoffet ble hentet fra spytt. Det vil bryte store, uoppløselige stivelsesmolekyler i løselig stivelse (amylodextrin, erytrodextrin og achrodextrin) og produsere suksessivt mindre stivelse og til slutt maltose. Ptyalin virker på lineære α (1,4) glykosidiske bindinger, men forbindelsehydrolyse krever et enzym som virker på forgrenede produkter. Spyttamylase inaktiveres i magen av magesyre. I magesaft justert til pH 3,3 ble ptyalin totalt inaktivert på 20 minutter ved 37 ° C. I motsetning til dette forble 50% av amylaseaktiviteten etter 150 minutters eksponering for magesaft ved pH 4,3. Både stivelse, substratet for ptyalin og produktet (korte kjeder av glukose) er i stand til delvis å beskytte det mot inaktivering av magesyre. Ptyalin tilsatt buffer ved pH 3,0 gjennomgikk fullstendig inaktivering på 120 minutter; tilsetning av stivelse på 0,1% nivå resulterte imidlertid i at 10% av aktiviteten gjensto, og lignende tilsetning av stivelse til et 1,0% nivå resulterte i at ca. 40% av aktiviteten gjensto i 120 minutter.
Optimale forhold for ptyalin
- Optimal pH – 7,0
- Menneskekroppstemperatur
- Tilstedeværelse av visse anioner og aktivatorer:
- Klorid og bromid – mest effektivt
- Jod – mindre effektiv
- Sulfat og fosfat – minst effektivt
Genetisk variasjon i human spyttamylase
Spyttamylasegenet har gjennomgått duplisering under evolusjon, og DNA-hybridiseringsstudier indikerer at mange individer har flere tandemgjentakelser av genet. Antall genkopier korrelerer med nivåene av spyttamylase, målt ved proteinblot-analyser ved bruk av antistoffer mot human amylase. Genekopienummer er assosiert med tilsynelatende evolusjonær eksponering for høystivelses dietter. For eksempel hadde et japansk individ 14 kopier av amylasegenet (en allel med 10 kopier, og en andre allel med fire kopier). Det japanske dietten har tradisjonelt inneholdt store mengder risstivelse. Derimot hadde et Biaka-individ seks eksemplarer (tre eksemplarer på hver allel). Biaka er regnskogjegersamlere som tradisjonelt har konsumert et diett med lite stivelse. Perry og kollegaer spekulerte i at det økte antallet kopier av spyttamylasegenet kan ha forbedret overlevelse sammenfallende med et skifte til et stivelsesholdig kosthold under menneskelig utvikling.
Bukspyttkjertelen amylase
Bukspyttkjertelen α-amylase spalter tilfeldig α (1-4) glykosidbindinger av amylose for å gi dekstrin, maltose eller maltotriose. Den vedtar en dobbelt forskyvningsmekanisme med opprettholdelse av anomerisk konfigurasjon. Hos mennesker utviklet spyttamylasen seg fra en kopi av den.
I patologi
Testen for amylase er lettere å utføre enn den for lipase, noe som gjør den til den primære testen som brukes til å oppdage og overvåke pankreatitt. Medisinske laboratorier vil vanligvis måle enten bukspyttkjertelamylase eller total amylase. Hvis det bare måles amylase i bukspyttkjertelen, vil en økning ikke bli notert med kusma eller andre spyttkjerteltraumer.
Imidlertid, på grunn av den lille mengden som er tilstede, er tidspunktet kritisk når du prøver blod for denne målingen. Blod bør tas kort tid etter smerter i pankreatitt, ellers skilles det raskt ut av nyrene.
Spytt α-amylase har blitt brukt som en biomarkør for stress og som en surrogatmarkør for sympatisk nervesystem (SNS) aktivitet som ikke krever blodtrekk.
Tolkning
Økte plasmanivåer hos mennesker finnes i:
- Spyttstraumer (inkludert bedøvelsesintubasjon)
- Kusma – på grunn av betennelse i spyttkjertlene
- Pankreatitt – på grunn av skade på cellene som produserer amylase
- Nyresvikt – på grunn av redusert utskillelse
Totale amylaseavlesninger på over 10 ganger øvre normalgrense (ULN) tyder på pankreatitt. Fem til ti ganger ULN kan indikere ileus eller tolvfingertarmsykdom eller nyresvikt, og lavere høyder er ofte funnet i spyttkjertelsykdom.
Gener
- spytt – AMY1A, AMY1B, AMY1C
- bukspyttkjertel – AMY2A, AMY2B
I korn
α-amylaseaktivitet i korn måles for eksempel ved Hagberg – Perten Falling Number, en test for å vurdere spireskader eller Phadebas-metoden. Forekommer i hvete.
Industriell bruk
α-Amylase brukes i etanolproduksjon for å bryte stivelse i korn til gjærbare sukkerarter.
Det første trinnet i produksjonen av høy-fruktose mais sirup er behandlingen av maisstivelse med α-amylase, og produserer kortere kjeder av sukker oligosakkarider.
En α-amylase kalt “Termamyl”, hentet fra Bacillus licheniformis, brukes også i noen vaskemidler, spesielt oppvask- og stivelsesfjernende vaskemidler.
Se amylase for mer bruk av amylasefamilien generelt.
Potensial for medisinsk bruk
α-amylase har vist effekt ved nedbrytning av polymikrobielle bakteriefilmer ved hydrolyse av α (1-4) glykosidiske koblinger i de strukturelle, matriseeksopolysakkaridene til det ekstracellulære polymere stoffet (EPS).
Bufferhemming
Tris-molekylet er rapportert å hemme et antall bakterielle α-amylaser, så de bør ikke brukes i tris-buffer.
Besluttsomhet
Flere metoder er tilgjengelige for bestemmelse av α-amylaseaktivitet, og forskjellige næringer pleier å stole på forskjellige metoder. Stivelsesjodtesten, en utvikling av jodtesten, er basert på fargeendring, ettersom α-amylase nedbryter stivelse og brukes ofte i mange applikasjoner. En lignende, men industrielt produsert test, er Phadebas-amylasetesten, som brukes som en kvalitativ og kvantitativ test innen mange bransjer, som vaskemidler, forskjellige mel-, korn- og maltmatvarer og rettsmedisinsk biologi.
Domenearkitektur
α-amylaser inneholder en rekke forskjellige proteindomener. Det katalytiske domenet har en struktur bestående av en åtte-strenget alfa / beta-fat som inneholder det aktive stedet, avbrutt av et ~ 70-aminosyre kalsiumbindende domene som stikker mellom beta-streng 3 og alfa-helix 3, og et karboksyl-terminal gresk nøkkel beta-fat domene. Flere alfa-amylaser inneholder et domene for beta-ark, vanligvis ved C-enden. Dette domenet er organisert som et femstrenget antiparallelt beta-ark. Flere alfa-amylaser inneholder et all-beta-domene, vanligvis ved C-enden.
.


Discussion about this post